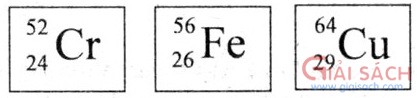
CROM Crom thuộc nhóm VIB, chu kì 4, có số hiệu nguyên tử là 24.
Crom có cấu hình electron nguyên từ 1s
22s
22p
63s
23p
63d
54s
1, hoặc có thể viết gọn là [Ar]3d
54s
1. Trong các hợp chất, crom có số oxi hoá biến đổi từ +1 đến +6.
Phổ biến hơn cả là các số oxi hoá +2, +3, +6.
Crom có màu trắng ánh bạc, rất cứng (rạch được thuỷ tinh, cứng nhất trong sổ các kim loại, độ cứng chi kém kim cương).
1. Tác dụng với phi kim Giống như kim loại nhôm, ở nhiệt độ thường trong không khí, kim loại crom tạo ra màng mỏng crom(III) oxit có cấu tạo mịn, đặc chắc và bền vững bảo vệ. Ở nhiệt độ cao, crom khử được nhiều phi kim.
0 +3
4Cr + 3O
2 => 2Cr
2O
3 0 +3
2Cr + 3Cl
2 => 2CrCl
3 2. Tác dụng với nước Không tác dụng được với nước do có màng oxit bảo vệ.
3. Tác dụng với axit Trong dung dịch HCl, H
2SO
4 loãng nóng, màng oxit bị phá huỷ, crom khử ion H+ tạo ra muối Cr(II) và khí hiđro.
0 +2
Cr+ 2HCl => CrCl
2 + H
2↑
Tương tự nhôm, crom không tác dụng với axit HNO
3 và H
2SO
4 đặc, nguội mà các axit này làm cho kim loại crom trở nên thụ động.
- Thép chứa từ 2,8 - 3,8% crom có độ cứng cao, bền, có khả năng chống gỉ.
- Thép có chứa 18% crom là thép không gỉ (thép inox).
- Thép chứa từ 25 - 30% crom có tính siêu cứng, dù ở nhiệt độ cao.
Trong đời sống, nhiều đồ vật bằng thép được mạ crom. Lớp mạ crom vừa có tác dụng bảo vệ kim loại khỏi bị ăn mòn, vừa tạo vẻ đẹp cho đồ vật. Thí dụ, bộ đồ ăn, dụng cụ nhà bếp và những đồ vật khác được mạ crom.
Hợp chất phổ biến nhất của crom là quặng cromit sắt FeO.Cr
2O
3, quặng này thường có lẫn Al
2O và SiO
2.
Oxit crom (Cr
2O
3) được tách ra từ quặng. Sau đó điều chế crom bàng phương pháp nhiệt nhôm:
t
oCr
2O
3 + 2Al => 2Cr + Al
2O
3 MỘT SỐ HỢP CHẤT CỦA CROM I. HỢP CHẤT CROM (II)1. Crom(II) oxit, CrO CrO là một oxit bazơ:
CrO + 2HCl => CrCl
2 + H
2O
CrO có tỉnh khử, trong không khí CrO dễ bị oxi hoá thành crom(III) oxit Cr
2O
3.
2. Crom(II) hiđrọxit, Cr(OH)2 Cr(OH)
2 là chất rắn, màu vàng, được điều ché từ muối crom(II) và dung dịch kiềm (không có không khí):
CrCl
2 + 2NaOH => Cr(OH)
2↓ + 2NaCl
Cr(OH)
2 có tỉnh khử, trong không khí Cr(OH)
2 bị oxi hoá thành Cr(OH)
3:
4Cr(OH)
2 + O
2 + 2H
2O => 4Cr(OH)
3 Cr(OH)
2 là một bazơ:
Cr(OH)
2 + 2HCl => CrCl
2 + 2H
2O
3. Muối crom(II) Muối crom(II) có tính khử mạnh:
2CrCl
2 + Cl
2 => 2CrCl
3 II. HỢP CHẤT CROM (III) 1. Crom(III) oxit, Cr2O3 Cr
2O
3 là một oxit lưỡng tính, tan trong axit và kiềm đặc. Cr
2O
3 được dùng tạo màu lục cho đồ sứ, đồ thuỷ tinh.
2. Crom(III) hiđroxit, Cr(OH)3 Cr(OH)
3 được điều ché bằng phản ứng trao đổi giữa muối crom(HI) và dung dịch bazơ:
CrCl
3 + 3NaOH => Cr(OH)
3↓ + 3NaCl
Cr(OH)
3 là hiđroxit lưỡng tính:
Cr(OH)
3 + NaOH Na[Cr(OH)
4] (hayNaCrO
2)
Cr(OH)
3 + 3HCl => CrCl
3 + 3H
2O
3. Muối crom (III) Muối crom(III) có tính oxi hóa và tính khử.
Trong môi trường axit, muối crom(III) có tính oxi hoá và dễ bị những chất khử như Zn khử thành muối crom(II):
+3 0 +2 +2
2Cr (dd) + Zn => 2Cr (dd) + Zn (dd)
Trong môi trường kiềm, muối crom(III) có tính khử và bị những chất oxi hoá mạnh oxi hoá thành muối crom(VI):
+3 0 +6 -1
2Cr(dd) + 3Br
2 + 16OH => 2CrO
4 (dd)+ 6Br(dd) + 8H
2O
Muối crom(III) quan trọng là muối sunfat kép crom-kali hay phèn crom-kali K
2SO.Cr
2(SO
4)
3.24H
2O (viết gọn là KCr(SO
4)
2.12H
2O). Phèn crom-kali có màu xanh tím, được dùng để thuộc da, làm chất cầm màu trong ngành nhuộm vải.
III. HỢP CHẤT CROM (VI) 1. Crom(VI) oxit, CrO
3 CrO3 là chất rắn, màu đỏ thẫm.
CrO3 có tính oxi hoá rất mạnh. Một số chất vô cơ và hữu cơ như S, P, C, NH
3, C
2H
5OH,... bốc cháy khi tiếp xúc với CrO
3, đồng thời CrO
3 bị khử thành Cr
2O
3.
2CrO
3 + 2NH
3 => Cr
2O
3 + N
2 + 3H
2O
CrO
3 là một oxit axit, tác dụng với nước tạo thành hỗn hợp axit cromic H
2CrO
4 và axit đicromic H
2Cr
2O
7:
CrO
3 + H
2O => H
2CrO
42CrO
3 + H
2O => H
2Cr
2O
7 Hai axit này không tách ra được ờ dạng tự do, chỉ tồn tại trong dung dịch. Neu tách khỏi dung dịch, chúng sẽ bị phân huỷ trở lại thành CrO
3 2. Muối cromat và đicromat Các muối cromat và đicromat có tính oxi hoá mạnh, đặc biệt trong môi trường axit, muối Cr(VI) bị khử thành muối Cr(III).
K
2Cr
2O
7 + 6FeSO
4 +7H
2SO
4 => Cr
2(SO
4)
3 +3Fe
2(SO
4)
3 + K
2SO
4 +7H
2O
K
2Cr
2O
7 + 6KI + 7H
2SO
4 => Cr
2(SO
4)
3 + 4K
2SO
4 + 3I
2. + 7H
2O
Trong môi trường thích hợp, các muối cromat và đicromat chuyển hoá lẫn nhau theo một cân bằng:
2CrO
4 + 2H
+ 
Cr
2O
2-7 + H
2(màu da cam) (màu vàng)