MỘT SỐ VẤN ĐỀ LÍ THUYẾT CẦN NẮM VỮNGI. KIM LOẠI KIỀM (IA) Có 1 electron ở lớp ngoài cùng.
 Năng lượng ion hoá:
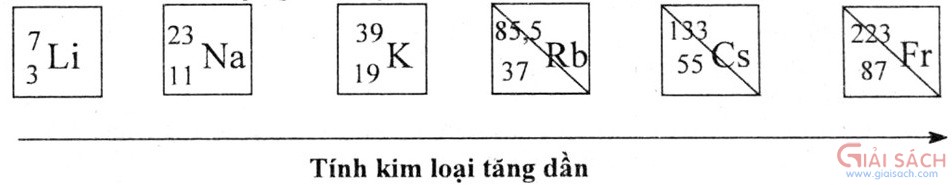
Năng lượng ion hoá: Các nguyên tử kim loại kiềm có năng lượng ion hoá li nhỏ nhất so với các kim loại khác.
Trong nhóm kim loại kiềm, năng lượng ion hoá I1 giảm dần từ Li đến Cs.
Số oxi hóa: Trong các hợp chất, nguyên tố kim loại kiềm chỉ có số oxi hoá +III. Nhiệt độ nóng chảy và nhiệt độ sôi cùa các kim loại kiềm thấp hơn nhiều so với các kim loại khác. Tính chất này là do lực liên kết kim loại trong mạng tinh thể kim loại kiềm kém bền vững.
1. Tác dụng với phi kim 2Na + O
2 => Na
2O
2 (r)
Natri tác dụng với oxi trong không khí khô ờ nhiệt độ phòng, tạo ra Na
2O:
4Na + O
2 => 2Na
2O (r)
2. Tác dụng với axitKim loại kiềm đều có thể khử dễ dàng ion H
+ của dung dịch axit (HCl, H
2SO
4 loãng) thành khí H
2 (phản ứng gây nổ nguy hiểm):
2Li + 2HCl => 2LiCl + H
2↑
3. Tác dụng với nước 2Na + 2H
2O => 2NaOH (dd) + H
2↑
2M + H
2O => 2MOH (dd) + H
2↑
Do vậy, các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hoả.
+ Ứng dụng và điều chế 1. Ứng dụng của kim loại kiềm Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy,...
Các kim loại kali và natri dùng làm chất trao đổi nhiệt trong một vài loại lò phản ứng hạt nhân.
Kim loại xesi dùng chế tạo tế bào quang điện.
Kim loại kiềm được dùng để điều chế một số kim loại hiếm bàng phương pháp nhiệt luyện.
Kim loại kiềm được dùng làm chất xúc tác trong nhiều phản ứng hữu cơ.
2. Điều chế kim loại kiềm Phương pháp điều chế kim loại kiềm là điện phân nóng chảy hợp chất halogenua của kim loại kiềm.
Để hạ nhiệt độ nóng chảy của NaCl ở 800°c xuống nhiệt độ thấp hơn, người ta dùng hỗn hợp gồm 2 phần NaCl và 3 phần CaCl
2 theo khối lượng. Hỗn hợp này có nhiệt độ nóng chảy dưới 600°c.
+ Một số hợp chất quan trọng,của kim loại kiềm
1. Natri hiđroxit, NaOHa. Tính chấtNatri hiđroxit là chất rắn, không màu, dễ hút ẩm, dễ nóng chảy (322°C), tan nhiều trong nước.
b. Ứng dụngNatri hiđroxit có nhiều ứng dụng quan trọng trong các ngành công nghiệp chế biến dầu mỏ, luyện nhôm, xà phòng, giấy, dệt,...
c. Điều chếTrong công nghiệp, người ta điều chế NaOH bàng cách điện phân dung dịch NaCl bão hoà. (có vách ngăn):
Điện phân2NaCl + 2H
2O ----------> H
2↑ + Cl
2↑ + 2NaOH
có vách ngăn 2. Natri hiđrocacbonat, NaHCO3 Tính chất t
o2NaHCO
3 --------> Na
2CO
3 + H
2O + CO
2↑
Muối NaHCO
3 có tính lưỡng tính, là tính chất của ion HCO
3-; tuy nhiên, tính bazơ chiếm ưu thế.
3. Natri cacbonat, Na2CO3 Natri cacbonat dễ tan trong nước, nóng chảy ở 850°c.
Na
2CO
3 là muối của axit yếu, tác dụng được với nhiều axit:
Na
2CO
3 + 2HCl => 2NaCl + H
2O + CO
2↑
II. KIM LOẠI KIỀM THỔ (IIA) Có 2 electron ở lớp ngoài cùng
 1. Tác dụng với phi kim
1. Tác dụng với phi kim Khi đốt nóng, các kim loại kiềm thổ đều bốc cháy trong không khí tạo ra oxit.
t
o2Mg + O
2 => 2MgO
t
oCa + Cl
2 => CaCl
2 2. Tác dụng với axitCa +2HCl => CaCl
2 + H
2↑
3. Tác dụng với nước Ca, Sr, Ba tác dụng với H
2O ở nhiệt độ thường tạo thành dung dịch bazơ. Mg tác dụng chậm với nước ở nhiệt độ thường tạo ra Mg(OH)
2, tác dụng nhanh với hơi nước ở nhiệt độ cao tạo thành MgO. Be không tác dụng với H
2O dù ở nhiệt độ cao.
Ca + 2H
2O => Ca(OH)
2 + H
2↑
Mg + H
2O => MgO + H
2↑
| Nguyên tố | Be | Mg | Ca | Sr | Ba |
| Cấu hình electron | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 |
[Xe]6s2
|
| Mạng tinh thể | Lục phương | Lập phương tâm diện | Lập phương tâm khối |
Các kim loại kiềm thổ đều có tính khử mạnh, nhưng yếu hơn so với kim loại kiềm. Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba.
III. NHÔM 
Có 3 electron ở lớp ngoài cùng.
Nhôm dẫn điện và dẫn nhiệt tốt. Độ dẫn nhiệt bằng 2/3 đồng nhưng lại nhẹ hơn đồng 3 lần. Độ dẫn điện của nhôm hơn sắt 3 lần.
1. Tác dụng với phi kim Nhôm tác dụng trực tiếp và mạnh với nhiều phi kim như O2, Cl
2, S,...
t
o4Al + 3O
2 => 2Al
2O
3 Nhôm bền trong không khí ở nhiệt độ thường do có màng oxit Al
2O
3 rất mỏng, mịn và bền chắc bảo vệ.
Bột nhôm tự bốc cháy khi tiếp xúc với khí clo:
2Al + 3Cl
2 => 2AlCl
3 2. Tác dụng với axit 2Al + 6HCl => 2AlCl
3 + 3H
2↑
2 Al + 6H
+ => 2Al
3+ + 3H
2↑
4Al + 4HNO
3loãng => Al(NO
3)
3 + NO + 2H
2O
2Al + 6H
2SO
4đặc => Al
2(SO
4)
3 + 3SO
2 + 6H
2O
Nhôm không tác dụng với H
2SO
4 và HNO
3 đặc, nguội. Những axit này đã oxi hoá bề mặt kim loại tạo thành một màng oxit có tính trơ, làm cho nhôm thụ động. Nhôm bị thụ động sẽ không tác dụng với các dung dịch HCl, H
2SO
4 loãng.
3. Tác dụng với oxit kim loại Ở nhiệt độ cao, Al khử được nhiều oxit kim loại như Fe
2O
3, Cr
2O,... thành kim loại tự do:
2Al + Fe
2O
3 => Al
2O
3 + 2Fe
4. Tác dụng với nước 2Al + 6H
2O => 2Al(OH)
3↓ + 3H
2↑
Phản ứng trên nhanh chóng dừng lại vì lớp Al(OH)
3 không tan trong nước đã ngăn cản không cho nhôm tiếp xúc với nước.
5. Tác dụng vói dung dịch kiềm 2Al + 2NaOH + 6H
2O => 2Na[Al(OH)
4](dd) + 3H
2↑
+ Ứng dụng và sản xuất1. Ứng dụng Nhôm và hợp kim nhôm có đặc tính nhẹ, bền đối với không khí và nước, được dùng làm vật liệu chế tạo máy bay, ôtô, tên lừa, tàu vũ trụ.
Nhôm và hợp kim nhôm có màu trắng bạc, đẹp, được dùng làm khung cửa và trang trí nội thất.
Nhôm có tính dẫn điện, dẫn nhiệt tốtj được dùng làm dây cáp dẫn điện thay thế cho đồng là kim loại đắt tiền. Nhôm được dùng chế tạo các thiết bị trao đổi nhiệt, các dụng cụ đun nấu trong gia đình.
Bột nhôm dùng để chế tạo hỗn hợp tecmit (hỗn hợp bột Al và Fe
2O
3), được dùng để hàn gắn đường ray,...
2. Sản xuất Trong công nghiệp, nhôm được sản xuất từ quặng boxit bàng phương pháp điện phân.
+ Một số hợp chất quan trọng của nhôm1. Nhôm oxita) Tính chất vật lý và trạng thái tự nhiên Nhôm oxit là chất rắn màu trắng, không tác dụng với nước và không tan trong nước. Nóng chảy ở 2050
oC
Trong tự nhiên, nhôm oxit tồn tại cả dạng ngậm nước và dạng khan.
Dạng ngậm nước như boxit Al
2O
3. 2H
2O là nguyên liệu quan trọng để sản xuất nhôm.
Dạng khan như emeri, có độ cứng cao, dùng làm đá mài. Corinđon là ngọc thạch rất cứng, cấu tạo tinh thể trong suốt, không màu. Corinđon thường có màu là do lẫn một số tạp chất oxit kim loại. Nếu tạp chất là Cr2O3, ngọc có màu đỏ tên là rubi, nếu tạp chất là TiO
2 và Fe
3O
4, ngọc có màu xanh tên là saphia.
Rubi và saphia nhân tạo được chế tạo bằng cách nung nóng hỗn hợp nhôm oxit với Cr
2O
3 hoặc TiO
2 và Fe
3O
4 b. Tính chất hoá họcTính lưỡng tínhAl
2O
3 + 6HCl => 2AlCl
3 + 3H
2O
Al
2O
3 + 2NaOH +3H
2O => 2Na[Al(OH)
4]
2. Nhôm hiđroxit Tính chất hóa học Nhôm hiđroxit (Al(OH)
3) là hợp chất không bền đối với nhiệt, khi đun nóng bị phân huỷ thành nhôm oxit:
t
o2Al(OH)
3 => Al
2O
3 + 3H
2O
Tính lưỡng tính Al(OH)
3 + 3HCl => AlCl
3 + 3H
2O
Al(OH)
3 + NaOH => Na[Al(OH)
4]
3. Nhôm sunfat Công thức hoá học phèn chua: K
2SO
4.Al
2(SO
4)
3.24H
2O = KAl(SO
4)
2.12H
2O. Nếu thay ion K
+ bằng Li
+ Na
+ hay NH
4+ ta được các muối kép khác có tên chung là phèn nhôm (không gọi phèn chua).
4. Cách nhận biết ion Al3+ trong dung dịch Cho từ từ dung dịch NaOH đến dư vào dung dịch thí nghiệm, nếu thấy có kết tủa keo xuất hiện rồi tan trong NaOH dư thì chứng tỏ có ion Al
3+Al
3+ +3OH => Al(OH)
3↓
Al(OH)
3 + OH
- (d-) => AlO
2 + 2H
2O